Hva skjer i hjernen når vi føler oss glade og optimistiske? Hvorfor virker penicillin mot bakterieinfeksjoner, mens paracet virker mot hodepine? Og hvordan i all verden kan antidepressiva påvirke humøret og dermed virke mot depresjon? Svaret er molekyler.

Forsker Aina Westrheim Ravna i sving foran datamaskinen. Hun forsker på legemidlers virkesteder i kroppen ved hjelp av molekylmodellering.
Foto: Bjørn-Kåre Iversen, UiT
Skrevet av: Aina Westrheim Ravna og Ingebrigt Sylte
Vi mennesker har et finjustert system hvor kroppens egne molekyler kommuniserer med hverandre, med celler som nerveceller og muskelceller, organer som hjerne, hjerte, lever og nyrer, slik at kroppens prosesser kan gå som normalt. Noen av disse kommunikasjonsmolekylene kalles reseptorer. Reseptorer er proteinmolekyler i kroppen. De tar imot signaler fra signalmolekyler, ved at signalmolekylet binder seg til reseptoren. Når denne bindingen skjer, vil reseptoren sende signalet videre, slik at vi får en effekt i kroppen. Molekylene som binder til reseptorene kan enten være kroppens egne signalmolekyler, eller de kan være medisiner.
Farmakologi
Farmakologi er læren om medisiner, det vil si hvordan medisiner virker i kroppen, og hva som skjer med medisinen fra den gis til pasienten til den er ute av kroppen. Dette faget inngår i en rekke universitetsstudier, som for eksempel medisinstudiet, tannlegestudiet, farmasistudiet, sykepleierstudiet og enkelte biologistudier. Farmakologi er en av grunnsteinene for legemiddelutvikling, og det er et viktig fag innen medisinsk forskning.
Sentralt i farmakologien er hvordan medisinene virker på reseptorene. Som nevnt er det proteinmolekyler. Medisinene kan binde seg til disse, og gi effekt. Andre proteintyper som medisiner kan virke på, er enzymer og transportører. Vi kaller slike proteiner for «drug targets» eller «legemiddelvirkesteder».
Penicillin og paracet er to eksempler på legemidler som virker på forskjellig vis. Penicillin forstyrrer dannelsen av bakteriens cellevegg, slik at bakterien dør. Paracet hemmer et enzym som er involvert i smerte. Det er de molekylære strukturene hos penicillin og paracet som avgjør hvorfor de virker akkurat der de gjør i kroppen, og dermed hvorfor penicillin virker mot bakterieinfeksjoner, mens paracet virker mot hodepine.
LEGO-klosser
Når et medisinmolekyl binder seg til reseptoren, dannes et såkalt reseptormedisin- kompleks. Dannelsen av et slikt kompleks kan stimulere eller hemme biologiske prosesser. Reseptorer vil bare kunne binde seg til spesielle medisinmolekyler. Det vil si at den enkelte reseptor lar seg påvirke av et fåtall molekyler med likhet i kjemisk struktur.
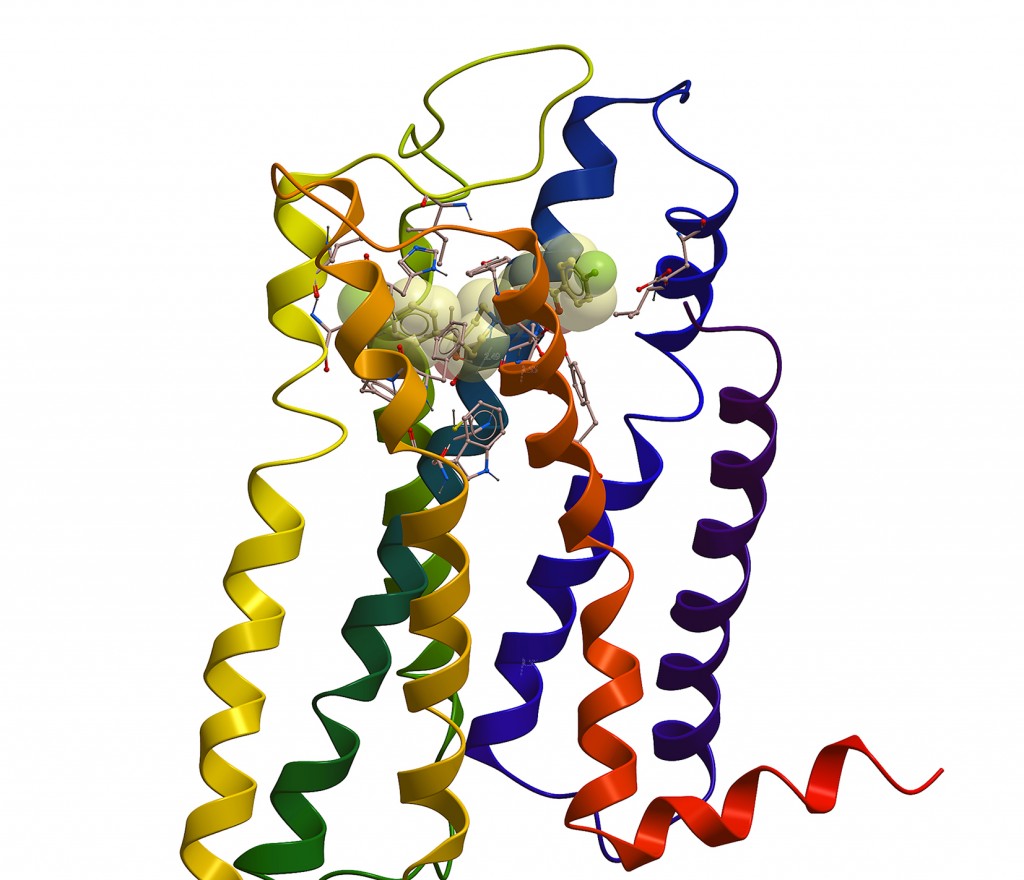
Modell av D2 dopaminreseptor med det antipsykotiske medikamentet haloperidol.
Illustrasjon: Kurt Kristiansen, UiT.
La oss gjøre et lite tankeeksperiment. Se for deg at reseptoren er et slags LEGO®-hus med et lite hulrom på taket hvor det akkurat er plass til en LEGOkloss. La oss si at åpningen er på størrelse med en kloss med 2×3 knotter. I denne åpningen vil du ikke få plass til LEGO-klosser som er større enn det, men du kan få plass til mindre klosser i tillegg til klosser med 2×3 knotter. Men effekten blir kanskje best dersom LEGOklossen passer akkurat. Slik er det også med medisinmolekyler og reseptorer.
Bivirkninger
Forskjellige reseptorer kan ha likhetstrekk. Dette medfører at noen medisinmolekyler kan binde seg til flere reseptorer, og gi opphav til flere ulike effekter. Kanskje ønsker vi bare effekt fra den ene reseptoren, og kanskje vil binding til den andre reseptoren gi en effekt vi ikke ønsker. En slik uønsket effekt av et legemiddel kaller vi bivirkning. Et eksempel på dette er astmamedisiner, som virker på reseptorer i lungene og hjelper astmatikere til å puste bedre. Men astmamedisinen kan også binde seg til en reseptor i hjertet som ligner på reseptoren i lungene. Når astmamedisin binder til reseptoren i hjertet vil man få hjertebank. Dette er en typisk bivirkning man kan få av astmamedisin.
Molekylmodellering og «Drug Design»

Det er to signalmolekyler i hjernen som er forbundet med humør; dopamin og serotonin. Dopamin skilles ut når vi har det gøy, mens serotonin gir en mer vedvarende form for tilfredshet.
Illustrasjonsfoto: Colourbox
For å forstå de molekylære mekanismene ved dannelsen av reseptor-medisin-kompleks, kan vi bruke noe som kalles molekylmodellering. Molekylmodellering er bygging og visualisering av tredimensjonale (3D) molekylstrukturer på datamaskiner. Det ligner på LEGObygging, men i stedet for LEGO-klosser bruker man molekyler, og i stedet for å gjøre det med hendene bruker man en datamaskin.
Binding av medisinmolekyler til reseptorer er svært strukturspesifikk. Dette betyr at bare medisinmolekyler med en viss sammensetning og struktur vil binde seg godt til reseptoren. Små forskjeller i molekylstruktur kan derfor gi store forskjeller i bindingsegenskaper og biologisk aktivitet. Et eksempel på det er legemidlet Klorprotiksen (Truxal®) som kan benyttes ved schizofreni og andre psykotiske lidelser (se figur av molekylstrukturen under).
En hypotese er at psykotiske lidelser skyldes at dopamin overstimulerer sine reseptorer i deler av hjernen. Medisinmolekyler som konkurrerer med dopamin om å binde til dopaminreseptorene, og hindrer dopaminstimulering, kan ha en gunstig effekt ved psykoser. De kalles for antipsykotika. Truxal er et antipsykotikum som kan eksistere i to strukturelle former, som kalles cis og trans. Formene har lik kjemisk sammensetning, men orienteringa av kjeden i forhold til ringsystemet er forskjellig (se figur). Forskning har vist at cis-formen har antipsykotisk effekt, mens trans-formen ikke har noen effekt.
Vi bruker molekylmodellering for å undersøke hvordan kontakten mellom medisinmolekylet og reseptoren ser ut. Vi kan blant annet se hvordan medisinmolekylet kan justeres og bygges om slik at det kanskje passer enda bedre i reseptoren. Å bygge om medisinmolekyler slik at de kan passe enda bedre i en reseptor kalles «Drug Design». Man kan også designe eller skreddersy medisinmolekyler som både passer bedre i en reseptor som vi ønsker effekt fra, og som passer dårligere i en reseptor vi ikke ønsker effekt fra. Slike designede medisinmolekyler kan bli nye medisiner, som kanskje virker bedre og har færre bivirkninger enn de som allerede er på markedet.
Medisiner mot depresjon
For å forklare hva som skjer i hjernen når man føler seg glad og optimistisk, kan man bruke molekylmodellering. Det er to signalmolekyler i hjernen som er forbundet med humør; dopamin og serotonin. Dopamin skilles ut når vi har det gøy, mens serotonin gir en mer vedvarende form for tilfredshet. Altså kan man si at de to signalmolekylene er involvert i to litt forskjellige typer godt humør. Dersom et medisinmolekyl øker dopaminkonsentrasjonen, kan man få så høy konsentrasjon av dopamin at man blir euforisk, det vil si opplever sterk lykkefølelse og opprømthet. Eufori er en felleseffekt for alle rusmidler, og det er en vesentlig årsak til at man kan bli avhengig av rusmidler. Medisinmolekyler som øker konsentrasjonen av serotonin hever stemningsleiet. De bedrer humøret på lengre sikt, og på en annen måte, enn medisinmolekyler som øker dopamin-konsentrasjonen. Medisiner som øker serotoninkonsentrasjonen og dermed hever stemningsleiet, kalles antidepressiva.

Figuren viser trans- (til venstre) og cis-formen av Truxal. Fargelegging av atomer, karbon og hydrogen: hvit, nitrogen: grønn, svovel: rød, klor: gul. Figuren viser også den såkalte vanntilgjengelige overflaten til Truxal. Overflaten er fargelagt i henhold til elektrostatiske krefter i overflaten. Rød: sterkt positiv ladning, blå: positivt ladning, gul: negativ ladning
(Kilde Sylte og Dahl, 1991).
Virkestedene i kroppen for medisinmolekyler som øker dopamin- og serotoninkonsentrasjonen ligner på hverandre. Det er viktig at nye antidepressiva bare øker serotoninkonsentrasjonen, og ikke dopaminkonsentrasjonen. Dersom de også øker dopaminkonsentrasjonen vil de i tillegg gi eufori, og de kan dermed ikke brukes som medisin. Dersom man benytter molekylmodellering til å se hvordan virkestedet til antidepressiva ser ut, og hvordan antidepressiva binder seg til dette virkestedet, kan man lettere designe legemidler som virker effektivt og mest mulig uten bivirkninger.
Fra datadesign til nytt antidepressiva
Selv om man har klart å designe et molekyl i datamaskinen som i teorien passer perfekt i virkestedet som øker serotoninkonsentrasjonen, men ikke i virkestedet som øker dopaminkonsentrasjonen, er det ikke sikkert at molekylet kan fungere som antidepressiv medisin. Først må molekylet lages ved hjelp av kjemiske syntesemetoder, noe som ofte kan være problematisk.
For pasienten er det oftest gunstig at medisinen kan svelges som en tablett. Når tabletten er svelget, vil kroppen betrakte medisinmolekylet som et fremmedstoff, og forsøke å hindre molekylet i å komme inn i kroppen og bli transportert til virkestedet. Kroppen forsøker derfor å omdanne molekylet til noe enklere, som den deretter kan kvitte seg med. Antall medisinmolekyler som faktisk når et virkested, og dermed bidrar til en økning av serotoninkonsentrasjon, kan være langt lavere enn det antallet som ble tilført kroppen. Man må derfor forsikre seg om at molekylet når virkestedet i et antall som er høyt nok til at økningen av serotoninnivået kan skje. Om så ikke er tilfelle, er det mulig at molekylets struktur må justeres og prosessen må startes på nytt. Dessuten er det viktig å finne ut om det molekylet kan gi skadelige effekter. Før molekylet kan godkjennes som et nytt antidepressivt legemiddel, må det derfor gjøres mange eksperimenter i laboratoriet, det må studeres i dyremodeller, og det må gjennomgå kliniske utprøvinger. Det kan derfor ta mer enn 10 år før et datamaskindesigna molekyl kan selges som et nytt antidepressiva.
Litteratur:
- Ingebrigt Sylte og Svein G. Dahl 1991: Three-dimensional structure and molecular dynamics of cis(Z) and trans(E)-chlorprothixene. Journal of Pharmaceutical Sciences 80: 735–40.
Denne artikkelen står også på trykk i Ottar nr. 4/2013: “Dopamin – molekylet for lyst, last og lidelse”
Forfatterne:
Aina Westrheim Ravna har doktorgrad i farmakologi og er førsteamanuensis og forskningsgruppeleder ved Helsefak, UiT. Ravna forsker på legemidlers virkesteder i kroppen ved hjelp av molekylmodellering med særlig fokus på legemidler for behandling av kreft og depresjon. Hun underviser i farmakologi for medisinerstudenter, tannlege-studenter, sykepleierstudenter og biologistudenter.
Ravna formidler populærvitenskapelige emner som dopamin, sjokolade, krydder og samisk folkemedisin (sjamanisme).
E-post: aina.w.ravna@uit.no
Ingebrigt Sylte er professor i farmakologi ved Helsefak, UiT. Sylte er medlem av forskningsgruppa Medisinsk farmakologi og toksikologi som studerer effekter av legemidler og giftstoffer. Gruppa bruker blant annet molekylmodellering og strukturell bioinformatikk til å studere struktur, molekylære mekanismer og interaksjoner av proteiner som mål for legemidler.
E-post: ingebrigt.sylte@uit.no
Stikkord: antidepressiva, bivirkninger, depresjon, dopamin, drug design, farmakologi, molekylmodellering
Categories: Lege- og rusmidler, Tanker og følelser







